С помощью уравнения электродных реакций можно определить количество веществ, выделившихся на электродах. При этом используется постоянная Фарадея, равная заряду одного моля электронов, то есть:
8,314 Дж/моль∙К
6,626∙10^(-34) Дж∙С
1,6∙10^19 Кл
9,648∙104 Кл/моль
Для данного количества электричества масса вещества, выделившегося на электроде, прямо пропорциональна эквивалентной массе вещества. Это формулировка:
первого закона Фарадея
второго закона Фарадея
закона Оствальда
закона Джоуля-Ленца
На иллюстрации изображён пример гальваностегии – одного из способов применения электролиза, который получается путём:

получения копий из цветного металла при помощи осаждения его из раствора или расплава под действием электрического тока на матрице, а также покрытием металлом неметаллических предметов
очисткой металлов от примесей электролизом с применением растворимого анода
нанесения металлических покрытий на поверхность металлических изделий для защиты от коррозии или для декоративного вида
получением активных металлов электролизом расплавов природных соединений
На схеме, приведённой ниже, показан электролиз расплава хлорида натрия. Что отмечено знаком вопроса?
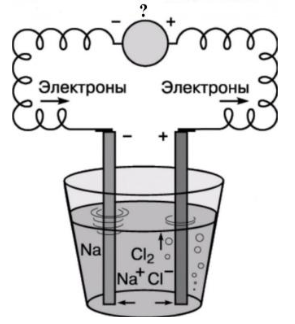
положительно заряженный электрод
отрицательно заряженный электрод
полупроницаемая мембрана
источник постоянного тока
Для максимально эффективной подготовки к предстоящему зачету или экзамену по химии используйте бесплатное тестирование на нашем сайте. В ходе работы над вопросами теста вы не только проверите свой уровень знаний, но и закрепите изученный ранее материал и обнаружите пробелы, над которыми стоит поработать. Проходите тестирование несколько раз, повторяйте темы и термины, систематизированные специалистами специально для вас.
Заказать решение тестов по химии у экспертов биржи Студворк!



Комментарии